ARTÍCULO ORIGINAL
A química da erva-mate Ilex paraguariensis em uma perspectiva interdisciplinar voltada à sustentabilidade
La química de la yerba mate Ilex paraguariensis en una perspectiva interdisciplinaria enfocada en la sustentabilidad
The chemistry of yerba mate Ilex paraguariensis in an interdisciplinary perspective focused on sustainability
Tonin,
Mariane Cristine 1 ![]() ; Ribeiro
dos Santos, Camila de Moraes 1
; Ribeiro
dos Santos, Camila de Moraes 1 ![]() ;
Nicolini, Keller Paulo 1
;
Nicolini, Keller Paulo 1 ![]() ;
Nicolini, Jaqueline 1
;
Nicolini, Jaqueline 1 ![]()
1 Colegiado de Química, Instituto Federal de Educação, Ciência e Tecnologia do Paraná – IFPR, 85555-000, Palmas-PR Brasil.
jaqueline.nicolini@ifpr.edu.br
DOI: https://doi.org/10.35305/agro44.e043
Recibido: Junio 2024 Aceptado: Octubre 2024
Resumo
O chimarrão é uma bebida típica no sul do Brasil caracterizada pela infusão de folhas e finos ramos da erva-mate (Ilex paraguariensis). A extração hidroalcóolica (método clássico) foi realizada para comparar os constituintes extraídos em etanol, 30%, com os constituintes extraídos em meio aquoso, simulando quais constituintes são ingeridos durante o consumo do chimarrão. Foram investigados os constituintes extraídos em temperaturas próximas de 60 ºC e 70 ºC. Os resultados provenientes de identificação colorimétrica indicam extração de catequinas e flavonóis em ambas as temperaturas, dependendo da região e da procedência da erva-mate. Já a presença de flavonóis, flavononas, flavononóis e xantonas livres e seus heterosídeos ocorre a 60 oC, o que também depende da região e da procedência da erva-mate. O teor total de antocianinas da erva-mate comercializada na região sudoeste do Paraná, Brasil, foi determinado por espectroscopia de ultravioleta-visível. As amostras de erva-mate investigadas apresentaram teores de antocianinas, em relação à cianidina-3-glicosídica de 4,09 ± 0,26% e 4,10 ± 0,37%. As antocianinas são flavonoides, que possuem ação antioxidante, indicando que beber chimarrão permite a implementação de antioxidantes na dieta alimentar. Dessa forma, o presente estudo propõe a avaliação fitoquímica dos extratos de erva-mate por identificação colorimétrica e investigação do teor de antocianinas presentes na erva-mate comercialmente vendidas, permitindo abordar o princípio 7 (Uso de Fontes Renováveis de Matéria-Prima) da Química Verde e atendendo princípios da ODS voltados à fome zero e agricultura sustentável (Objetivo 2), saúde e bem estar (Objetivo 3); educação de qualidade (Objetivo 4); cidades e comunidades sustentáveis (Objetivo 11) e consumo e produção responsáveis (Objetivo 12).
Palavras-chave: erva-mate; flavonoides; antioxidante
Resumen
El mate es una bebida típica del sur de Brasil que se caracteriza por la infusión de hojas y finas ramas de la yerba mate (Ilex paraguariensis). La extracción hidroalcohólica (método clásico) se realizó para comparar los constituyentes extraídos en etanol al 30% con los constituyentes extraídos del medio acuoso, simulando qué constituyentes son ingeridos durante el consumo del mate. Se investigaron los constituyentes extraídos a temperaturas cercanas a 60 ºC y 70 ºC. Los resultados de la identificación colorimétrica indican extracción de catequinas y flavonoles a ambas temperaturas, dependiendo de la región y origen de la yerba mate. La presencia de flavonoles libres, flavononas, flavonoles y xantonas y sus heterósidos se produce a 60 oC, lo que también depende de la región y origen de la yerba mate. El contenido total de antocianinas de la yerba mate comercializada en la región suroeste de Paraná, Brasil, se determinó mediante espectroscopía ultravioleta visible. Las muestras de yerba mate investigadas mostraron contenidos de antocianinas, en relación a cianidina-3-glucosídica de 4,09 ± 0,26% y 4,10 ± 0,37%. Las antocianinas son flavonoides que tienen acción antioxidante, lo que indica que beber mate permite la incorporación de antioxidantes en la dieta alimentaria. Por lo tanto, este estudio propone la evaluación fitoquímica de extractos de yerba mate mediante identificación colorimétrica e investigación del contenido de antocianinas presentes en la yerba mate comercializada, permitiéndonos abordar el principio 7 (Uso de Fuentes Renovables de Materia Prima) de la Química Verde y cumplir con los principios de los ODS enfocados sobre hambre cero y agricultura sostenible (Objetivo 2); salud y bienestar (Objetivo 3); educación de calidad (Objetivo 4); Ciudades y comunidades sostenibles (Objetivo 11); consumo y producción responsables (Objetivo 12).
Palabras clave: yerba mate; flavonoides; antioxidante
Abstract
The “chimarrão” is a typical drink in the south of Brazil made by the infusion of leaves and fine branches of yerba mate (Ilex paraguariensis). In this work, we performed hydroalcoholic extraction (conventional method) to compare the constituents extracted in 30% ethanol with the constituents extracted from the aqueous medium, simulating the constituents ingested during the consumption of chimarrão. The constituents extracted at temperatures close to 60 ºC and 70 ºC were investigated. The results from colorimetric identification indicated extraction of catechins and flavonols at both temperatures, depending on the region and origin of the yerba mate. The presence of free flavonols, flavonones, flavonols and xanthones and their heterosides occurs at 60 oC, also depending on the region and origin of the yerba mate. The total anthocyanin content of commercial yerba mate sold in the southwest region of Paraná, Brazil, was determined using ultraviolet visible spectroscopy. The values of the anthocyanin cyanidin-3-glucoside in the yerba mate samples analyzed were 4.09 ± 0.26% and 4.10 ± 0.37%. Since anthocyanins are flavonoids with antioxidant action, chimarrão consumption enhances dietary intake of antioxidants. The phytochemical evaluation of yerba mate extracts by colorimetric identification and investigation of the anthocyanin content in commercial yerba mate performed in this study represent a contribution towards addressing Principle 7 of Green Chemistry (Use of Raw Materials from Renewable Sources) and the UN Sustainable Development Goals focused on zero hunger and sustainable agriculture (Goal 2); good health and well-being (Goal 3); quality education (Goal 4); sustainable cities and communities (Goal 11); and responsible consumption and production (Goal 12).
Keywords: yerba mate; flavonoids; antioxidant
Introdução
Distribuição geográfica da erva-mate (Ilex Paraguariensis) e consumo
A erva-mate (Ilex paraguariensis) é da família das plantas sagradas, Aquifoliaceae (Heck y De Mejia, 2007), sendo uma espécie arbórea nativa de formações florestais com importância socioeconômica em grande parte da região sul do Brasil (Marques et al., 2019), sendo Argentina e Brasil os países de destaque em produtos e tecnologias patenteadas sobre erva-mate (Alves y Scheer, 2024). Um breve histórico da erva-mate nos leva a observar que ela assumiu um importante papel econômico na Região Sul do Brasil (Alves et al., 2001), sendo que há evidências de que a erva-mate abastecia o mercado interno do Paraguai, Buenos Aires e Montevidéu, via rio Paraná desde 1816 e que, por volta de 1800 a exportação de mate do Brasil se intensificou para abastecer os mercados platinos e o Chile (Gerhardt, 2006).
Na Argentina e no Uruguai, a infusão de erva-mate é chamada de “mate” enquanto no Brasil é denominada de “mate” ou “chimarrão” (Pintos et al., 1994). De acordo com a Resolução RDC n. 302 de 07 de novembro de 2002, item 2.1.2 do anexo desta Resolução, a erva-mate é definida como: “produto constituído, exclusivamente, pelas folhas e ramos, das variedades de Ilex paraguariensis, na forma inteira ou moída obtido através de processo de secagem e fragmentação, o qual constitui matéria-prima para chimarrão e tererê. Não é considerada erva-mate, a matéria-prima que teve, parcial ou totalmente, retirados os princípios ativos, por qualquer processo tecnológico”, sendo que quando consumida com água quente é denominada de chimarrão (Brasil, 2002). O chimarrão é uma bebida típica no sul do Brasil e consiste na utilização das folhas e dos galhos finos da erva-mate (Ilex paraguariensis) (Figura 1A) como matéria prima (Santin et al., 2017), sendo o consumo diário estimado em mais de 1 L/pessoa (Mateos et al., 2018), possuindo modo de consumo legítimo, apresentando propriedades farmacológicas, tais como anti-inflamatória, antioxidante, entre outras (Mesquita et al., 2021). O consumo do chimarrão em temperaturas próximas a ebulição não são recomendadas pela sua correlação com câncer do trato aero digestivo superior (Goldenberg et al., 2003; Kaltbach et al., 2022; Pintos et al., 1994), podendo estar ligado a 20% dos casos de câncer de cabeça e pescoço (Pintos et al., 1994). Assim, a temperatura ideal para o consumo do chimarrão varia entre 60 ºC e 70 ºC (Tertulia, 2024) e consiste geralmente em um mate amargo (sem açúcar) que se toma compactando a erva-mate processada (Figura 1B) numa cuia de porongo (Lagenaria siceraria) utilizando uma bomba de metal (Figura 1C), com adição de água aquecida.

Figura 1. (A) Folhas de erva-mate. (B) Erva-mate processada. (C) Bomba e cuia utilizados no consumo do chimarrão
Compostos bioativos da erva-mate (Ilex Paraguariensis): Perspectiva sustentável e interdisciplinar
De acordo com Corrêa (2023) “a sustentabilidade nos agronegócios visa um compromisso com o gerenciamento de modelos de produção consciente”, sendo que “o cultivo da erva-mate é, portanto, uma atividade do agronegócio que pode ser associada a manutenção de áreas nativas, onde estas podem ser manejadas para extrativismo” (Corrêa, 2023). Dessa maneira, diferentes formas de cultivo, tais como sistemas agroecológicos, os quais não utilizam defensivos agrícolas, boas práticas de produção, como por exemplo, o cultivo de erva-mate através de sistema sombreado (De Lacerda y De Lacerda, 2019), o qual promove a regeneração natural (De Lacerda, 2022) e sendo cultivado juntamente com outras espécies nativas, reduz o impacto ambiental (Corrêa, 2023). É possível destacar nestas práticas ações de sustentabilidade e preservação ambiental, sendo que a erva-mate, é uma espécie nativa e renovável (Paletta et al., 2015) e que desta maneira, pode ser enquadrada na categoria de espécies florestais com condições de recuperar áreas classificadas como reserva legal ou de preservação permanente (Corrêa, 2023).
Essa abordagem, está em consonância com ações relacionadas ao desenvolvimento de processos que reduzem ou eliminam a geração de resíduos tóxicos (Lenardão et al., 2003) propostos pela Química Verde, visto que a Química Verde visa utilizar reagentes e processos “amigos do ambiente” (Wasilewska et al., 2023). O termo Química Verde é um termo que surgiu na década de 90 (1990), a partir de reuniões entre Chefes de Estado, durante a cúpula das Nações Unidas, que objetivavam propor medidas para a redução de emissões ou o controle da degradação de reservas ambientais e o desenvolvimento autossustentável (Objetivos de Desenvolvimento Sustentável – ODS) (Anastas y Eghbali, 2010; Anastas y Williamson, 1996). Dessa forma, o presente estudo também contribui para fortalecer os Objetivos de Desenvolvimento Sustentável (ODS) propostos pela ONU, sendo: Objetivo 2: “Fome Zero e Agricultura Sustentável”; Objetivo 3: “Saúde e Bem Estar”; Objetivo 4: “Educação de Qualidade”; Objetivo 11: “Cidades e Comunidades Sustentáveis” e Objetivo 12: “Consumo e Produção Responsáveis” (Onu, 2024).
Relacionado ao Objetivo 3 da ODS (Saúde e Bem Estar), destacam-se as propriedades da erva mate (Maiocchi, 2017). A erva-mate apresenta benefícios para a saúde humana pelas propriedades digestivas, diuréticas e laxantes, além de vitaminas essenciais (Stagg y Millin, 1975). Esta planta é muito comum no sul do Brasil (Saidelles et al., 2010) e apesar de seu potencial antioxidante, quando cultivada em solos ricos em metais como o alumínio pode ter relação com o desenvolvimento de doenças degenerativas como o Alzheimer (Bortoli et al., 2018), porém, com potencial para prevenção de doenças cardiovasculares (Junior y Morand, 2016). Isso porque, a erva-mate possui em sua constituição compostos com propriedades antioxidantes, vasodilatadoras, antimutagênicas e anticarcinogênicas (Bracesco et al., 2011). Estudos têm mostrado que a erva-mate é muito usada como uma bebida funcional por possuir em seus constituintes um número elevado de bioativos essenciais ao organismo (Mateos et al., 2018).
Dentre os compostos orgânicos presentes na erva-mate, há compostos fenólicos que incluem os flavonoides, que possuem sítios disponíveis para a complexação do alumínio (Bernardi et al., 2017), reduzindo sua toxicidade (De Campos et al., 2014). As principais classes de fitoquímicos presentes na erva-mate são os polifenóis, metilxantinas e saponinas (Junior y Morand, 2016). A composição na matéria seca da erva-mate indica que seu consumo pode ser um importante meio de ingestão dos elementos minerais N, P, K, Ca, Mg, S, B, Cu, Fe, Mn, Zn, Al, e Na (Heinrichs y Malavolta, 2001; Maiocchi, 2017) e de vários flavonoides (Bracesco et al., 2011), sendo que estudos realizados mostram que a ingestão do chimarrão pode contribuir para diminuir os níveis de colesterol no sangue e triglicérides, mas não influencia nas taxas de glicose (Castaldelli et al., 2011). O consumo de bebidas derivadas da erva-mate indica ação hipocolesterolemiante, hepatoprotetora e protetor cardiovascular (Chandrasekara y Shahidi, 2018). Mesmo a altas temperaturas, e com a diminuição do conteúdo de fitoquímicos, bebidas de erva-mate mantêm suas propriedades funcionais tais como atividades antioxidante, antibacteriana e antitumoral (Correa et al., 2017). Este trabalho objetiva: i) Realizar uma avaliação fitoquímica através da identificação colorimétrica dos principais bioativos que são consumidos durante a ingestão do chimarrão na temperatura ideal; ii) Abordar de forma interdisciplinar constituintes presentes na erva-mate, valorizando as potencialidades da matriz regional; iii) Promover uma discussão de interface relacionada à química verde, sustentabilidade e meio ambiente, fortalecendo os Objetivos de Desenvolvimento Sustentável (ODS) propostos pelas Nações Unidas e pela ONU, voltados para fome zero e agricultura sustentável, saúde e bem estar, educação de qualidade, cidades e comunidades sustentáveis e consumo e produção responsáveis (Onu, 2024).
Materiais e métodos
Materiais e reagentes
Foram testadas duas diferentes marcas de erva-mate vendidas comercialmente e provenientes dos estados do Paraná e de Santa Catarina, Brasil, as quais são denominadas Erva-Mate 1 (EM1) e Erva-Mate 2 (EM2). A amostra EM1 é proveniente da região Sudoeste do Paraná, com solo classificado como nitossolo (Bhering et al., 2007; Lima, 2016). A amostra EM2, é proveniente da região oeste de Santa Catarina, a partir de ervais nativos, em sistema agroecológico, sem o uso de defensivos agrícolas, com solo classificado como campo subtropical úmido (Embrapa, 2004). Também foram utilizados hidróxido de sódio (NaOH, pureza de 99,0%, Neon), ácido clorídrico (HCl, pureza de 37,0%, Neon), cloreto férrico hexa-hidratado (FeCl3.6 H2O, pureza de 97-102%, Vetec), etanol (pureza de 99,8%, Neon) e magnésio metálico em aparas (Mg, teor mínimo de 99,5%, Dinâmica).
Obtenção dos extratos hidroetanólico e aquoso
Para a obtenção dos extratos foi adaptado o método descrito por Matos (2009).
Extrato hidroetanólico (método clássico): Foi utilizado 25 g de erva-mate macerada em almofariz e pistilo na presença de 100 ml de etanol 30% (V/V) (extrato hidroetanólico) sob agitação frequente em banho-Maria até 74 º C (Matos, 2009).
Extrato aquoso: A extração utilizando água, foi realizada em duas diferentes temperaturas. As temperaturas utilizadas para a extração foram de 74 ºC e 60 oC, estando próxima a faixa de temperaturas recomendadas para o consumo do chimarrão (entre 60 e 70 oC) (Barros et al., 2000; Tertulia, 2024) pois acima de 70 oC a água é considerada quente, podendo causar danos ao esôfago (Barros et al., 2000).
Etapas após as extrações hidroetanólica e aquosa: Após as extrações, os extratos foram filtrados a quente para remoção da fração sólida grosseira e depois o líquido foi filtrado à vácuo em papel filtro com tamanho de poro de 14 μm. O volume do extrato obtido foi ajustado, sendo diluído para 50 ml de modo a obter a relação de uma parte da planta para duas do volume final (Matos, 2009).
Estes extratos, foram separados em sete (7) tubos de ensaio numerados de 1 à 7, com 4 ml de extrato em cada tubo, para serem realizados os protocolos de identificação colorimétrica para a presença de fenois e taninos (em 1 - Presença de fenois e taninos, tubo 1), antocianinas, antocianidinas e flavonoides (em 2 - Presença de antocianinas, antocianidinas e flavonoides, tubos 2-4), leucoantocianidinas, catequinas e flavonas (em 3 - Presença de leucoantocianidinas, catequinas e flavonas, tubos 5 e 6) e flavonóis, flavononas, flavononóis e xantonas (em 4 - Presença de flavonóis, flavononas, flavononóis e xantonas, tubo 7). As análises foram realizadas em triplicata.
Para a determinação do pH das amostras, foi utilizado um pHmetro digital de bancada (Kasvi) utilizando soluções tampão padrão (Vetec) pH 4,00 e pH 7,00 para calibrar o pHmetro, com erro de ± 0,02. Os extratos apresentaram pH = 6,00.
Identificação colorimétrica: Avaliação fitoquímica dos extratos de erva-mate
Para a identificação dos constituintes presentes nos extratos de erva-mate foi realizada a análise química qualitativa através de reações químicas de coloração ou de precipitado colorido de acordo com Matos (2009):
1 - Presença de fenois e taninos: Adicionar ao tubo 1, três (3) gotas de solução alcoólica de FeCl3, concentração de 0,01 mol L-1. Repetir o procedimento em um teste “referência”.
2 - Presença de antocianinas, antocianidinas e flavonoides: Tubos 2, 3 e 4. Acidular com HCl o tubo 2 até pH 3; alcalinizar com NaOH o tubo 3 até pH 8,5 e alcalinizar com NaOH o tubo 4 até pH 11. Nesta análise, a cor do meio indica os constituintes presentes nos extratos. Sendo: a) A presença de antocianinas e antocianidinas é indicada pela coloração vermelha em pH 3, lilás em pH 8,5 e azul-púrpura em pH 11. b) A presença de flavonas, flavonóis e xantonas é indicada pela cor do meio em pH 3 e 8,5 inalterada e amarela em pH 11. c) A presença de chalconas e auronas é indicada pela coloração vermelha em pH 3, inalterada em pH 8,5 e vermelho-púrpura em pH 11. d) A presença de flavonóis não altera a coloração do meio em pH 3 e 8,5 e apresenta cor vermelho-laranja em pH 11.
3 - Presença de leucoantocianidinas, catequinas e flavonas: Tubos 5 e 6. O tubo 5 foi acidulado com HCl até pH entre 1 e 3 e o tubo 6 alcalinizado com NaOH até pH 11. Os tubos foram aquecidos com o auxílio de uma lamparina durante 3 minutos, cuidadosamente. A variação das cores desta análise precisa ser comparada com as cores do protocolo descrito em “2 - Presença de antocianinas, antocianidinas e flavonoides”, comparando diretamente a cor do tubo 2 com o tubo 5 e a cor do tubo 4 com o tubo 6. Esta análise pode indicar: a) presença de leucoantocianidinas pela coloração vermelha do tubo 5 e quando a cor do extrato no tubo 6 for igual ao tubo 4; b) presença de catequinas quando o tubo 5 apresentar cor pardo-amarelado e a cor do extrato no tubo 6 for igual ao tubo 4; c) presença de flavanonas quando o tubo 5 apresentar a mesma cor do extrato presente no tubo 2 e coloração vermelho-laranja no tubo 6.
4 - Presença de flavonóis, flavononas, flavononóis e xantonas: Ao tubo 7 foi adicionado 0,02 g de magnésio metálico em aparas e 0,5 ml de HCl concentrado. O término da reação é caracterizado pelo fim da efervescência. O aparecimento de cor vermelha é indicativo da presença de flavonóis, flavononas, flavononóis e xantonas livres ou seus heterosídeos.
Determinação do teor de antocianinas
Considerando a presença de antocianinas totais, mesmo que em baixa concentração nas folhas de erva-mate, que não passaram pelo processamento (Silva y Nicolini, 2020), também propôs-se a determinação do teor total de antocianinas nos extratos das ervas-mates comerciais estudadas neste trabalho. O cálculo para a determinação do teor de antocianinas (TA) total é obtido em porcentagem (%), sendo calculado em relação à cianidina-3-glicosídica (Sandre et al., 2014) (Equação 1). É comum realizar esse tipo de cálculo para investigação do teor de antocianinas em diversos extratos vegetais (Sandre et al., 2014; Silva et al., 2020). Essa equação é empregada quando utiliza-se metanol acidulado com ácido clorídrico, 1% (MeOH/HCl, 1%) como solvente extrator (Sandre et al., 2014), sendo: A: valor da absorbância em 528 nm; FD: fator de diluição, 772: absorbância específica da cianidina-3-glicosídica; e m: massa da amostra (g). A extração foi realizada em triplicata, utilizando 0,1000 ± 0,0030 g de material vegetal e 5,0 ml do solvente extrator (MeOH/HCl, 1%). Este método permite a extração completa de antocianinas (Harborne, 1998). O extrato foi filtrado e ajustado para 10 ml com MeOH/HCl, 1%.
![]() [ Eq.1
]
[ Eq.1
]
Resultados
Avaliação fitoquímica por identificação colorimétrica dos extratos de erva-mate: Características, atividades químicas, farmacológicas e biológicas
1 - Presença de fenois e taninos
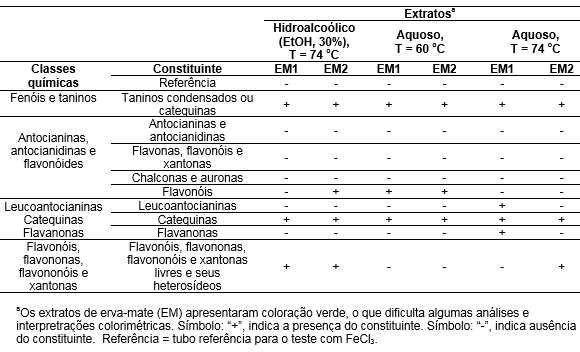
Nos testes realizados o teste “referência” para fenóis e taninos foi negativo. Em soluções diluídas de cloreto férrico, a presença de fenóis e taninos hidrolisáveis é indicada pela presença de uma forte coloração azul, principalmente em meio alcalino (Simões et al., 2003), o que não foi observado em nenhum dos extratos testados. Já soluções aquosas de derivados de catequina, resultam em coloração verde, cuja intensidade é mais fraca que os taninos hidrolisáveis (De Andrade y De Medeiros Simões, 2018). Nos três (3) extratos (hidroalcoólico: 74 oC; e aquosos: 60 oC e 74 oC) da amostra EM1 houve a formação de precipitado verde claro, indicando a presença de taninos condensados ou catequinas (Matos, 2009). Quando há misturas de ambos os tipos de taninos, a coloração verde não é observada (Matos, 2009; Simões et al., 2003), neste caso, sem precipitado verde claro. Os extratos das amostras EM2 (hidroalcoólico e aquoso) se mantiveram da mesma cor, sem a formação de precipitado verde mais claro, indicando a presença de ambos os tipos de taninos.
2 - Presença de antocianinas, antocianidinas e flavonoides
As amostras EM1 e EM2 demonstraram coloração indicativa para a presença de flavonóis no extrato hidroalcoólico (74 oC) e aquoso obtido à 60 oC. Os testes indicativos da presença de antocianinas e antocianidinas; flavonas, flavonóis e xantonas; chalconas e auronas foram negativos para todas as amostras de erva-mate em todos os extratos obtidos em todas as temperaturas testadas.
3 - Presença de leucoantocianidinas, catequinas e flavonas
Observou-se a presença de catequinas nas três amostras de erva-mate nos três meios analisados. Estes resultados complementam os resultados obtidos em “1 - Presença de fenois e taninos” indicando que a amostra EM1 apresenta taninos condensados e catequinas, enquanto a amostra EM2 apresenta apenas taninos condensados.
4 - Presença de flavonóis, flavononas, flavononóis e xantonas
O aparecimento ou intensificação da cor do extrato obtido confirma a presença de flavonóis, flavononas, flavononóis e/ou xantonas livres e seus heterosídios. Observou-se a cor vermelha em meio ácido na presença de magnésio metálico nos extratos hidroalcoólico e aquoso obtido à 60 oC da amostra EM1.
A Tabela 1 resume os resultados obtidos neste trabalho sumarizando ao final de cada etapa a presença ou a ausência dos grupos químicos investigados a partir das análises colorimétricas realizadas.
Tabela 1. Avaliação
fitoquímica dos extratos de erva-mate de amostras comerciais por identificação
colorimétrica.
Teor de antocianinas
O uso de método para extração completa de antocianinas foi realizado visando detalhar mais sobre esses constituintes, tendo em vista o caráter antioxidante destes flanonoides. O teor de antocianinas total, calculado a partir da Equação 1, e determinado para as amostras testadas de erva-mate vendidas comercialmente indica a porcentagem de antocianinas em relação à cianidina-3-glicosídica de 4,09 ± 0,26% para a amostra EM1 e 4,10 ± 0,37% para a EM2.
Discussão
Avaliação fitoquímica por identificação colorimétrica dos extratos de erva-mate: Características, atividades químicas, farmacológicas e biológicas
1 - Presença de fenois e taninos
Por serem fenólicos, os taninos são muito reativos, formam ligações de hidrogênio, intra e intermoleculares (Monteiro et al., 2005). Os taninos, condensados ou hidrolisáveis: têm ação bactericida e fungicida; podem complexar íons metálicos, tais como ferro, manganês, vanádio, cobre, alumínio e cálcio; têm ação antioxidante; podem complexar com proteínas e polissacarídeos (Simões et al., 2003). Dessa forma, a ingestão de uma pequena quantidade do tipo certo de taninos pode ser benéfica para a saúde humana (Chung et al., 1998). Alguns dos taninos vegetais mais comuns são (+)catequina, (-)catequina, (+)-galocatequina, (-)-epigalocatequina, (-)-epigalocatequina-3-O-galato, leucocianidina, leucopelargonidina, leucodelfinidina, guibourtacacidina, (+)-leucorobinetinidina, (-)-melacacinida e (-)-teracadinina (Chung et al., 1998), sendo que em extratos contendo erva-mate (Ilex paraguariensis) a literatura descreve a presença de (+)-catequina, (−)-epicatequina, (−)-epigalocatequina e (−)-epicatequina-2-O-galato (Santos et al., 2018), os quais são apresentados na Figura 2. A literatura também descreve que folhas de goiabeira (Psidium guajava) (Amadike Ugbogu et al., 2022) e espinheira-santa (Maytenus ilicifolia) (De Souza et al., 2008) são plantas com altos teores de taninos.
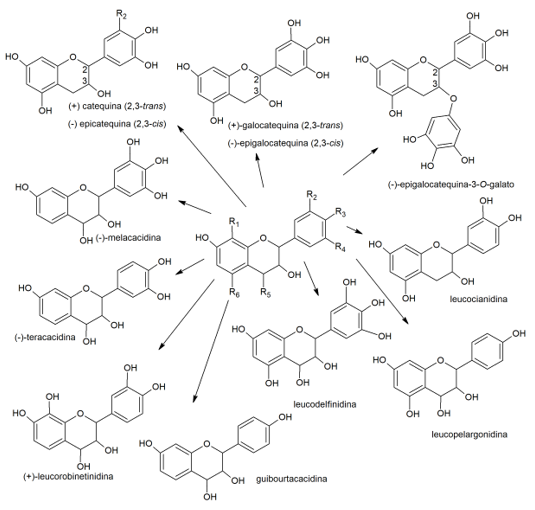
Figura 2. Taninos vegetais. Adaptado de Chung, Wei e Johnson (1998)(Chung et al., 1998).
2 - Presença de antocianinas, antocianidinas e flavonoides
Os flavonóis fazem parte de um grande grupo de flavonoides e geralmente agem como antioxidantes (Pitura y Arntfield, 2019), atuando como quelantes de espécies como por exemplo, níquel e alumínio (Bernardi et al., 2017; De Castilho et al., 2018). Frutas, como maçã (Malus domestica), cereja (Prunus cerasus) e ameixa (Prunus domestica); vegetais como couve-flor (Brassica oleracea) – conhecido como var. botrytis, brócolis (Brassica oleracea) – conhecido como var. italica - e cebola (Allium cepa); e bebidas como chá e vinho tinto são as principais fontes de flavonóis na dieta humana (Aherne y O’brien, 2002). Os flavonóis geralmente identificados em extratos de erva-mate são a rutina e a quercetina glicosídica (Mateos et al., 2018; Souza et al., 2015), além de kaempferol-ramnoglicosídeo e kaempferol-glicosídeo (Mateos et al., 2018), sendo apresentados na Figura 3. Todavia, estudos demonstram que o consumo de chimarrão em temperaturas acima de 80 °C promove a degradação de rutina, enquanto que os ácidos clorogênicos, têm transferência favorecida para a bebida chimarrão quando consumida em temperaturas próximas a 100 °C (Da Silveira et al., 2016).
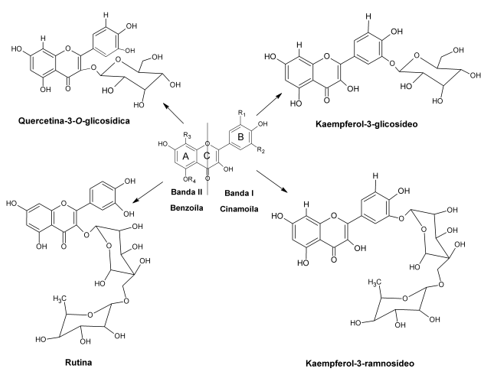
Figura 3.
Principais flavonóis presentes na erva-mate.
Os flavonoides possuem diversas funções nas plantas, tais como: proteção contra incidência de raios ultravioletas e visível; atração de insetos e animais visando a polinização; ação antioxidante (Simões et al., 2003). Os flavonoides compreendem uma grande classe de compostos vegetais, sendo fitoquímicos com muitas propriedades medicinais (Badshah et al., 2021) e terapêuticas (Abou Baker, 2022), podendo citar, por exemplo potencial ação antiviral (Badshah et al., 2021) antioxidante (Rodríguez-Arce y Saldías, 2021), anti-inflamatória (Rakha et al., 2022), antitumoral (Posadino et al., 2023). Alguns flavonoides podem ser encontrados em diversas plantas tais como jaboticaba (Plinia cauliflora) (Chua et al., 2023), açaí (Euterpe oleracea) e morango (Fragaria vesca) (Posadino et al., 2023) ou no sabugueiro (Sambucus australis) (Badshah et al., 2021), uma planta invasora com propriedades medicinais (Fortes et al., 2009).
3
- Presença de leucoantocianidinas, catequinas e flavonas
Os taninos são responsáveis pela adstringência de muitos frutos e produtos vegetais, estando amplamente distribuídos em plantas lenhosas, tais como quebracho (espécies de Schinopsis - gênero botânico de árvores nativas da América do Sul) e acácia (Acacia mearnsii) tendo ação bactericida e fungicida, antiviral e antitumoral (Simões et al., 2003). Os taninos podem exercer seus efeitos positivos para a saúde devido à sua atividade antioxidante no trato gastrointestinal produzindo efeitos locais ou devido à bioatividade dos seus metabolitos capazes de serem absorvidos durante a fermentação no cólon contribuindo para a ação dos taninos em vários órgãos (Le Bourvellec y Renard, 2018), além da capacidade de complexação com íons metálicos (Simões et al., 2003) ou interação com macromoléculas biológicas (Le Bourvellec y Renard, 2018; Simões et al., 2003), isso porque a especificidade da interação de taninos com proteínas depende fortemente de sua estrutura, sendo geralmente aceito que os taninos com maior massa molecular se ligam mais fortemente às proteínas (Sekowski et al., 2018). Foi verificada a presença de flavanonas apenas na amostra EM1, no extrato aquoso obtido à 74 oC. As flavanonas são uma subclasse dos flavonoides, sendo que as flavanonas mais comuns são a hesperidina e a naringina (Ameer et al., 1996; Do Nascimento et al., 2018) caracterizadas como intermediários biossintéticos da maioria das classes de flavonoides (Simões et al., 2003) presentes principalmente em frutas cítricas (Ameer et al., 1996). A hesperidina pode ser encontrada no limão (Citrus lemon), laranja (Citrus sinensis) ou em maior concentração na hortelã-pimenta (Mentha piperita), entre outros frutos (Pandey y Khan, 2021). A hesperidina apresenta potenciais propriedades antitumorais. As flavanonas cítricas são frequentemente ligadas às suas propriedades anti-hiperglicêmicas (Do Nascimento et al., 2018). Já a naringina também está presente em diversas frutas cítricas, por exemplo nas limas, tais como a lima de bico (Citrus limetta) (Gupta et al., 2021) e na bergamota ou laranja-bergamota (Citrus bergamia) apresentando correlação no metabolismo lipídico, tais como na regulação da digestão lipídica e transporte reverso do colesterol (Yang et al., 2022). As flavanonas em Ilex paraguariensis têm ação antioxidante (Hao et al., 2013) contribuindo na melhoria das funções hepáticas (Rizk et al., 2018).
4 - Presença de flavonóis, flavononas, flavononóis e xantonas
Estes compostos são derivados de flavonoides e sua presença em extratos de Ilex paraguariensis tem ação antioxidante sobre a oxidação de LDL (lipoproteínas de baixa viscosidade) (Mayer et al., 2024; Simões et al., 2003). Os constituintes vegetais que podem ser extraídos dependem da região geográfica de procedência do extrato (Okumura et al., 2002), bem como da temperatura (Da Silveira et al., 2016). No caso da erva-mate, há evidências de que a adubação fosfatada reduz a relação entre massas verde e seca (Santin et al., 2017) e que os tipos e taxas de constituintes vegetais variam significativamente em relação ao morfotipo da erva-mate e a idade da planta, influenciando nas taxas de nitrogênio e nos teores de cafeína, teobromina e de taninos (Borille et al., 2005). Os solos de procedência das erva-mates testadas são diferentes, sendo EM1 proveniente da região Sudoeste do Paraná, com solo classificado como nitossolo (Bhering et al., 2007; Lima, 2016) e EM2 proveniente da região oeste de Santa Catarina com solo classificado como campo subtropical úmido (Embrapa, 2004).
A literatura descreve que os principais compostos encontrados na erva-mate são a cafeína, um alcalóide xantínico; ácido clorogênico, sendo este um composto fenólico com ação antioxidante; saponinas triterpênicas, responsáveis pela formação da espuma após a adição da água à erva-mate, tendo ação antifúngica; além da presença de clorofila, caracterizando a coloração verde típica da bebida chimarrão (Maiocchi, 2017). Além disso, Maiochi (2017) ainda descreve a presença de diversas vitaminas durante o consumo do chimarrão, tais como, vitamina A, vitamina C (ácido L-ascórbico) e vitaminas do complexo B, sendo: tiamina (B1), riboflavina (B2), niacina (B3), ácido pantotênico (B5), piridoxina (B6), ácido fólico (B9) e cianocobalamina (B12) (Maiocchi, 2017).
Teor de antocianinas
Estudos anteriores indicaram que o teor de antocianinas determinado para folhas de erva-mate, foi de 3,05 ± 0,13% (Silva y Nicolini, 2020). Conforme literatura (De Loose, 1969; Okumura et al., 2002), a presença, ausência ou concentração de antocianinas varia conforme a região geográfica de coleta. Dessa maneira, mesmo que a prospecção fitoquímica não tenha indicado a presença de antocianina, as análises espectrocópicas, tais como a espectroscopia de ultravioleta-visível (UV-Vis), por ser mais sensível, indicou a presença de antocianinas, mesmo que em baixa concentração.
As antocianinas são corantes naturais (Gürses et al., 2016; Haddar et al., 2018; Khoo et al., 2017; Wrolstad, 2004; Wrolstad et al., 2005) pertencentes a classe dos flavonoides coloridos (Chen y Hrazdina, 1981; Santos et al., 2017; Tao et al., 2023; Veitch y Grayer, 2008; Williams y Grayer, 2004), responsáveis pelas cores vermelho, rosa, roxo e azul de flores (Cooper-Driver, 2001; Goto y Kondo, 1991; Yoshida et al., 2009) como o agapanto (Agapanthus africanus), os lírios (Lilium) (Silva et al., 2020) e a centáurea azul (Centaurea cyanus) (Yoshida et al., 2009); frutos como a uva (Vitis vinifera) (Aherne y O’brien, 2002); grãos como o feijão (Phaseolus) (Da Silva et al., 2018; Mojica et al., 2017); raízes e legumes (Cooper-Driver, 2001; Silva et al., 2017) tais como beterraba (Beta vulgaris), repolho-roxo (Brassica oleracea) - conhecido como var. capitata -, romã (Punica granatum) e cenoura preta (Daucus carota) (Silva et al., 2017). As antocianinas apresentam relevantes propriedades biológicas e farmacológicas, tais como ação antioxidante (Rodríguez-Arce y Saldías, 2021), anti-inflamatória (Rakha et al., 2022) e antitumoral (Posadino et al., 2023).
Sustentabilidade e meio ambiente
A erva-mate é um produto presente no sul do Brasil, compondo parte da matriz regional, bem como da região de realização deste trabalho. A valorização da matriz regional, através de investigações e estudo de classes químicas e fitoquímicas promove a integração de definições que permeiam diversas áreas, permitindo envolver assim pesquisadores e estudantes de química, biologia, farmácia e agronomia, por exemplo. É possível promover discussões acerca da constituição química da erva-mate, mas também sobre aplicações e usos em novos materiais (Girelli et al., 2019) tais como o porongo (Bojić et al., 2017; Bojić et al., 2013; Nikolić et al., 2021; Stanković et al., 2016), que pode ser empregado como adsorvente verde (De Lima et al., 2021; Franceschini et al., 2023), bem como ponto de partida para estudos de catálise. A prospecção química realizada, investiga a presença de flavonoides. As análises colorimétricas realizadas se complementam, pois muitas vezes é abordada uma subclasse de flavonoides sem abordar a outra. Isso provoca a investigação científica e contribui para a construção conceitual com gradientes de complexidade. A prospecção fitoquímica, utilizando extrato etanólico (De Souza et al., 2023) promove discussões sobre a ciência, sua importância, bem como aplicações.
Este artigo permite promover discussão sobre diversas interfaces, voltadas à química verde, sustentabilidade e meio ambiente, fortalecendo os Objetivos de Desenvolvimento Sustentável (ODS) proposto pela ONU voltados a “Fome Zero e Agricultura Sustentável” (Objetivo 2), “Saúde e Bem Estar” (Objetivo 3), “Educação de Qualidade” (Objetivo 4), “Cidades e Comunidades Sustentáveis” (Objetivo 11) e “Consumo e Produção Responsáveis” (Objetivo 12). A proposta de realizar a prospecção fitoquímica utilizando solventes de menor grau de toxidade, também permite promover a discussão sobre segurança dos indivíduos que realizam a atividade. Dessa maneira, a Química Verde se refere ao desenvolvimento de processos que reduzem ou eliminam a geração de resíduos tóxicos (Lenardão et al., 2003), fortalecendo a “química limpa”. Dentre os 12 princípios da Química Verde (QV) (Lenardão et al., 2003) o desenvolvimento desta investigação, atende aos princípios: 1 (Prevenção), 5 (Solventes e Auxiliares mais Seguros), 7 (Uso de Fontes Renováveis de Matéria-Prima) e 12 (Química Intrinsecamente Segura para a Prevenção de Acidentes) da Química Verde.
Conclusões
Através da identificação colorimétrica, foram avaliados os constituintes fenólicos extraídos de amostras de erva-mate comercial nas temperaturas 60 oC e de 74 oC. A investigação, permite simular em água, os constituintes extraídos durante o consumo do chimarrão. Assim, pode-se inferir que a extração de catequinas e flavonóis irá ocorrer, em ambas as temperaturas, dependendo da região e da procedência da erva-mate. Já a presença de flavonóis, flavononas, flavononóis e xantonas livres e seus heterosídeos ocorre a 60 oC, o que também depende da região e da procedência da erva-mate. A abordagem apresentada neste estudo permite fortalecer os objetivos 2, 3, 4, 11 e 12 de desenvolvimento sustentável (ODS) propostos pela ONU (Onu, 2024). Além disso, promove e fortalece os objetivos da ODS voltados à Química Verde. A investigação apresentada neste manuscrito mostra-se contextualizadora permitindo ainda sugerir em estudos futuros investigações voltadas para atividades químicas, farmacológicas, biológicas e com variações na adubação do solo, permitindo investigar os diversos fitoquímicos presentes em plantas, através de uma abordagem interdisciplinar e ambientalmente amigável.
Agradecimentos
Os autores agradecem ao Instituto Federal de Educação, Ciência e Tecnologia do Paraná (IFPR) e ao Programa de Bolsas de Inclusão Social da Fundação Araucária (PIBIS/FA).
Declaração de autoria (CRedit)
MCT: Investigação. Redação inicial. Análise preliminar.
CMRS: Investigação. Redação inicial. Análise preliminar.
KPN: Investigação. Redação inicial. Análise preliminar. Análise formal.
JN: Análise preliminar. Supervisão. Análise formal. Escrita. Revisão. Edição.
ABOU BAKER, D. H. (2022). An ethnopharmacological review on the therapeutical properties of flavonoids and their mechanisms of actions: A comprehensive review based on up to date knowledge. Toxicology Reports. 9, 445-469.
AHERNE, S. A.; O’BRIEN, N. M. (2002). Dietary flavonols: chemistry, food content, and metabolism. Nutrition. 18, 1, 75-81.
ALVES, F. E. D. S. B.; SCHEER, A. D. P. (2024). Yerba mate (Ilex paraguariensis), science, technology and health: A systematic review on research, recent advances and possible paths for future studies. South African Journal of Botany. 168, 573-587.
ALVES, L. F.; SANTANA, D. L.; BRANCALHÃO, R. M. C. (2001). Ocorrência de Perigonia lusca (Fabr.)(Lep.: Sphingidae) em erva-mate (Ilex paraguariensis) no Brasil. Neotropical Entomology. 30, 2, 339-340.
AMADIKE UGBOGU, E.; EMMANUEL, O.; EBUBECHI UCHE, M.; DIKE DIKE, E.; CHUKWUEBUKA OKORO, B.; IBE, C.; CHIBUEZE UDE, V.; NWABU EKWEOGU, C.; CHINYERE UGBOGU, O. (2022). The ethnobotanical, phytochemistry and pharmacological activities of Psidium guajava L. Arabian Journal of Chemistry. 15, 5, 103759.
AMEER, B.; WEINTRAUB, R. A.; JOHNSON, J. V.; YOST, R. A.; ROUSEFF, R. L. (1996). Flavanone absorption after naringin, hesperidin, and citrus administration. Clinical Pharmacology & Therapeutics. 60, 1, 34-40.
ANASTAS, P.; EGHBALI, N. (2010). Green chemistry: principles and practice. Chemical Society Reviews. 39, 1, 301-312.
ANASTAS, P. T.; WILLIAMSON, T. C. Green chemistry: an overview. Washington, DC: ACS Publications, 1996.
BADSHAH, S. L.; FAISAL, S.; MUHAMMAD, A.; POULSON, B. G.; EMWAS, A. H.; JAREMKO, M. (2021). Antiviral activities of flavonoids. Biomedicine & Pharmacotherapy. 140, 111596.
BARROS, S. G. S. D., et al. (2000). Mate (chimarrão) é consumido em alta temperatura por população sob risco para o carcinoma epidermóide de esôfago. Arquivos de Gastroenterologia. 37, 25-30.
BERNARDI, F.; NICOLINI, K. P.; NICOLINI, J. (2017). Use of UV-Vis spectroscopy to detection of quercetin in plants by formation of quercetin-aluminum complex. Infarma. 29, 3, 271-276.
BHERING, S. B.; DOS SANTOS, H.; MANZATTO, C.; BOGNOLA, I.; FASOLO, P.; DE CARVALHO, A.; POTTER, R.; CURCIO, G. (2007). Mapa de solos do estado do Paraná. Embrapa Solo Floresta, Rio de Janeiro. Documentos 96, 73.
BOJIĆ, D.; MOMČILOVIĆ, M.; MILENKOVIĆ, D.; MITROVIĆ, J.; BANKOVIĆ, P.; VELINOV, N.; NIKOLIĆ, G. (2017). Characterization of a low cost Lagenaria vulgaris based carbon for ranitidine removal from aqueous solutions. Arabian Journal of Chemistry. 10, 7, 956-964.
BOJIĆ, D. V.; RANĐELOVIĆ, M. S.; ZARUBICA, A. R.; MITROVIĆ, J. Z.; RADOVIĆ, M. D.; PURENOVIĆ, M. M.; BOJIĆ, A. L. (2013). Comparison of new biosorbents based on chemically modified Lagenaria vulgaris shell. Desalination and Water Treatment. 51, 34-36, 6871-6881.
BORILLE, Â. M. W.; REISSMANN, C. B.; DE FREITAS, R. J. S. (2005). Relação entre compostos fitoquímicos e o nitrogênio em morfotipos de erva-mate (Ilex paraguariensis St. Hil.). Boletim do Centro de Pesquisa de Processamento de Alimentos. 23, 1, 183-198.
BORTOLI, P. M., et al. (2018). Ilex paraguariensis: Potential antioxidant on aluminium toxicity, in an experimental model of Alzheimer's disease. Journal of Inorganic Biochemistry. 181, 104-110.
BRACESCO, N.; SANCHEZ, A.; CONTRERAS, V.; MENINI, T.; GUGLIUCCI, A. (2011). Recent advances on Ilex paraguariensis research: minireview. Journal of Ethnopharmacology. 136, 3, 378-384.
BRASIL. (2002). Ministério da Saúde. Resolução RDC n.302, de 07 de novembro de 2002. Dispõe sobre o regulamento técnico para fixação de identidade e qualidade para erva-mate. 08 de nov, p.50.
CASTALDELLI, A. P. A.; VIEIRA, L. P.; PRZYGODDA, F.; MARTINS, Z. N.; PADOIN, M. J. (2011). Efeito da erva mate (Ilex paraguariensis A. St.-Hil.) no comportamento e fisiologia de ratos Wistar. Revista Brasileira de Biociências. 9, 4, 514.
CHANDRASEKARA, A.; SHAHIDI, F. (2018). Herbal beverages: Bioactive compounds and their role in disease risk reduction - A review. Journal of Traditional and Complementary Medicine.
CHEN, L.-J.; HRAZDINA, G. (1981). Structural aspects of anthocyanin-flavonoid complex formation and its role in plant color. Phytochemistry. 20, 2, 297-303.
CHUA, L. S.; ABD WAHAB, N. S.; SOO, J. (2023). Water soluble phenolics, flavonoids and anthocyanins extracted from jaboticaba berries using maceration with ultrasonic pretreatment. Food Chemistry Advances. 3, 100387.
CHUNG, K.-T.; WEI, C.-I.; JOHNSON, M. G. (1998). Are tannins a double-edged sword in biology and health? Trends in Food Science & Technology. 9, 4, 168-175.
COOPER-DRIVER, G. A. (2001). Contributions of Jeffrey Harborne and co-workers to the study of anthocyanins. Phytochemistry. 56, 3, 229-236.
CORRÊA, A. C. Índice de sustentabilidade na indústria da erva-mate. Universidade Federal de Santa Maria UFSM, RS, 2023. Disponível em: https://repositorio.ufsm.br/bitstream/handle/1/30162/DIS_PPGAGRONEG%C3%93CIOS_2023_CORREA_ANDERSON.pdf?sequence=1
CORREA, V. G., et al. (2017). Effects of in vitro digestion and in vitro colonic fermentation on stability and functional properties of yerba mate (Ilex paraguariensis A. St. Hil.) beverages. Food Chemistry. 237, 453-460.
DA SILVA, D. B.; GONÇALVES, M. D. M.; KREVE, Y. D.; NICOLINI, K. P.; NICOLINI, J. (2018). Coleção de propostas utilizando produtos naturais para a introdução ao tema ácido-base (Parte II): extração e armazenamento. Educación Química. 29, 2, 3-16.
DA SILVEIRA, T. F. F.; MEINHART, A. D.; DE SOUZA, T. C. L.; TEIXEIRA FILHO, J.; GODOY, H. T. (2016). Phenolic compounds from yerba mate based beverages – A multivariate optimisation. Food Chemistry. 190, 1159-1167.
DE ANDRADE, R. A.; DE MEDEIROS SIMÕES, A. S. (2018). Drogas: uma proposta de metodologia da problematização no Ensino de Química. Revista Thema. 15, 1, 5-24.
DE CAMPOS, B. K.; DOS PRAZERES, J. P.; TORRES, Y. R.; VANESSA EGÉA DOS ANJOS I, I.; QUINÁIA, S. P. (2014). Avaliação da labilidade de alumínio em infusões de erva-mate empregando voltametria adsortiva de redissolução catódica. Quimica Nova. 37, 9, 1479-1486.
DE CASTILHO, T. S.; MATIAS, T. B.; NICOLINI, K. P.; NICOLINI, J. (2018). Study of interaction between metal ions and quercetin. Food Science and Human Wellness. 7, 3, 215-219.
DE LACERDA, A. Erva-mate sombreada: sistemas para a recomposição do dossel e da diversidade via manejo da regeneração natural. Colombo-PR: Embrapa Floresta, 2022. Disponível em: https://www.infoteca.cnptia.embrapa.br/infoteca/handle/doc/1149021
DE LACERDA, A. E. B.; DE LACERDA, A. E. B. Série erva-mate sombreada (2): Sistema de restauração produtivo agroflorestal. Colombo-PR: Embrapa Floresta, 2019. Disponível em: https://ainfo.cnptia.embrapa.br/digital/bitstream/item/205685/1/CT-440-1677-final.pdf
DE LIMA, K. D.; DA SILVA, Y. A.; NICOLINI, K. P.; NICOLINI, J. (2021). Porongo como biossorvente: Características físico-químicas, aplicações tecnológicas e ambientais. Revista Mundi Engenharia, Tecnologia e Gestão (ISSN: 2525-4782). 6, 4.
DE LOOSE, R. (1969). The flower pigments of the Belgian hybrids of Rhododendron simsii and other species and varieties from Rhododendron subseries obtusum. Phytochemistry. 8, 1, 253-259.
DE SOUZA, A. B., et al. (2023). Antibacterial activity and anxiolytic-like effect of Ziziphus joazeiro Mart. leaves in adult zebrafish (Danio rerio). Fish and Shellfish Immunology Reports. 5, 100108.
DE SOUZA, L. M.; CIPRIANI, T. R.; IACOMINI, M.; GORIN, P. A. J.; SASSAKI, G. L. (2008). HPLC/ESI-MS and NMR analysis of flavonoids and tannins in bioactive extract from leaves of Maytenus ilicifolia. Journal of Pharmaceutical and Biomedical Analysis. 47, 1, 59-67.
DO NASCIMENTO, G. S., et al. (2018). The acute effects of citrus flavanones on the metabolism of glycogen and monosaccharides in the isolated perfused rat liver. Toxicology Letters. 291, 158-172.
EMBRAPA. (2004). Solos do Estado de Santa catarina. Embrapa Solos, Rio de Janeiro. 745.
FORTES, A. M. T.; MAULI, M. M.; ROSA, D. M.; PICCOLO, G.; MARQUES, D. S.; REFOSCO, R. M. D. C. (2009). Efeito alelopático de sabugueiro e capim-limão na germinação de picão-preto e soja. Acta Scientiarum Agronomy. 31, 241-246.
FRANCESCHINI, S. B.; SENDESKI, C. P.; LIMA, K. D.; NICOLINI, K. P.; NICOLINI, J. (2023). A ‘green’adsorbent: effect of chemical modification of biosorbents on the adsorption of methylene blue and malachite green. Anais da Academia Brasileira de Ciências. 95, e20210124.
GERHARDT, M. 2006. História ambiental da erva-mate. Universidade Federal de Santa Catarina, Brasil.
GIRELLI, G. C.; CORDEIRO, M. E.; NICOLINI, J.; NICOLINI, K. P. (2019). Reflectance and ultraviolet spectroscopy: predicting the relative growth of Saccharomyces cerevisiae in pine biomass. Spectroscopy Letters. 52, 2, 91-97.
GOLDENBERG, D.; GOLZ, A.; JOACHIMS, H. Z. (2003). The beverage mate: a risk factor for cancer of the head and neck. Head & Neck: Journal for the Sciences and Specialties of the Head and Neck. 25, 7, 595-601.
GOTO, T.; KONDO, T. (1991). Structure and Molecular Stacking of Anthocyanins - Flower Color Variation. Angewandte Chemie International Edition in English. 30, 1, 17-33.
GUPTA, A. K.; MISHRA, P.; SENAPATI, M.; SAHU, P. P. (2021). A novel electrochemical device for naringin quantification and removal from bitter variety of citrus fruits. Journal of Food Engineering. 306, 110637.
GÜRSES, A.; AÇıKYıLDıZ, M.; GÜNEŞ, K.; GÜRSES, M. S. 2016. Dyes and pigments: their structure and properties, Dyes and Pigments: 13-29: Springer.
HADDAR, W.; BEN TICHA, M.; MEKSI, N.; GUESMI, A. (2018). Application of anthocyanins as natural dye extracted from Brassica oleracea L. var. capitata f. rubra: dyeing studies of wool and silk fibres Natural Product Research. 32, 2, 141-148.
HAO, D.; GU, X.; XIAO, P.; LIANG, Z.; XU, L.; PENG, Y. (2013). Research progress in the phytochemistry and biology of Ilex pharmaceutical resources. Acta Pharmaceutica Sinica B. 3, 1, 8-19.
HARBORNE, J. B. Phytochemical methods: A guide to modern techniques of plant analyses 3a ed. Chapman & Hall: London, 1998.
HECK, C. I.; DE MEJIA, E. G. (2007). Yerba Mate Tea (Ilex paraguariensis): a comprehensive review on chemistry, health implications, and technological considerations. Journal of Food Science. 72, 9, R138-R151.
HEINRICHS, R.; MALAVOLTA, E. (2001). Mineral composition of a commercial product from mate-herb (Ilex paraguariensis St. Hil.). Ciência Rural. 31, 5, 781-785.
JUNIOR, E. L. C.; MORAND, C. (2016). Interest of mate (Ilex paraguariensis A. St.-Hil.) as a new natural functional food to preserve human cardiovascular health–A review. Journal of Functional Foods. 21, 440-454.
KALTBACH, P.; BALLERT, S.; GILLMEISTER, M.; KABRODT, K.; SCHELLENBERG, I. (2022). Mate (Ilex paraguariensis) tea preparations: Understanding the extraction of volatile and non-volatile compounds upon variations of the traditional consecutive infusions. Food Chemistry. 374, 131756.
KHOO, H. E.; AZLAN, A.; TANG, S. T.; LIM, S. M. (2017). Anthocyanidins and anthocyanins: Colored pigments as food, pharmaceutical ingredients, and the potential health benefits. Food & Nutrition Research. 61, 1, 1361779.
LE BOURVELLEC, C.; RENARD, C. M. G. C. Interactions Between Polyphenols and Macromolecules: Effect of Tannin Structure. Avignon: Elsevier, 2018. http://www.sciencedirect.com/science/article/pii/B9780081005965214868
LENARDÃO, E. J.; FREITAG, R. A.; DABDOUB, M. J.; BATISTA, A. C. F.; SILVEIRA, C. D. C. (2003). "Green chemistry": os 12 princípios da química verde e sua inserção nas atividades de ensino e pesquisa. Química Nova. 26, -, 123-129.
LIMA, M. R. Principais solos do estado do Paraná. In: Abordando o solo na escola: para professores do ensino fundamental e médio. . Curitiba: Secretaria Estadual de Educação do Paraná, Universidade Federal do Paraná/Programa Solo na Escola-UFPR, 2016. 22 p., 2016. Disponível em: https://issuu.com/solonaescola/docs/solosparana
MAIOCCHI, M. G. Capítulo 5, Composición Química. Conocer mejor lo que nos gusta tanto. En: Capellari, (2017) (Ed.), Yerba mate, reseña histórica y estadística, producción e industrialización en el siglo XXI: CABA, Argentina, Consejo Federal de Inversiones, 2017. Disponível em: https://issuu.com/susana0367/docs/yerba_mate_rese_a_historica_y_estad
MARQUES, A. D. C.; REIS, M. S. D.; DENARDIN, V. F. (2019). Yerba mate landscapes: forest use and socio-environmental conservation. Ambiente & Sociedade. 22, e02822.
MATEOS, R.; BAEZA, G.; SARRIÁ, B.; BRAVO, L. (2018). Improved LC-MSn characterization of hydroxycinnamic acid derivatives and flavonols in different commercial mate (Ilex paraguariensis) brands. Quantification of polyphenols, methylxanthines, and antioxidant activity. Food Chemistry. 241, -, 232-241.
MATOS, F. J. A. Introdução à fitoquímica experimental 3. ed. Fortaleza: Ediçoes UFC, 2009.
MAYER, M. S.; PORTELLA, A. F.; MAÇALAI, C.; ZAMBRA, A. L.; MORI, N. C.; KESSLER NUNES, V. C.; BORTOLOTTO, J. W.; AZZOLIN, G. B.; PARISI, M. M. (2024). Yerba Mate as a Protectant against Lipoproteins Oxidation. Chemistry & Biodiversity. 21, 4, e202301770.
MESQUITA, M.; SANTOS, E.; KASSUYA, C. A.; SALVADOR, M. J. (2021). Chimarrão, terere and mate-tea in legitimate technology modes of preparation and consume: A comparative study of chemical composition, antioxidant, anti-inflammatory and anti-anxiety properties of the mostly consumed beverages of Ilex paraguariensis St. Hil. Journal of Ethnopharmacology. 279, 114401.
MOJICA, L.; BERHOW, M.; GONZALEZ DE MEJIA, E. (2017). Black bean anthocyanin-rich extracts as food colorants: Physicochemical stability and antidiabetes potential. Food Chemistry. 229, 628-639.
MONTEIRO, J. M.; ALBUQUERQUE, U. P. D.; ARAÚJO, E. D. L.; AMORIM, E. L. C. D. (2005). Taninos: uma abordagem da química à ecologia. Química Nova. 28, 892-896.
NIKOLIĆ, G. S.; MARKOVIĆ NIKOLIĆ, D.; NIKOLIĆ, T.; STOJADINOVIĆ, D.; ANDJELKOVIĆ, T.; KOSTIĆ, M.; BOJIĆ, A. (2021). Nitrate removal by sorbent derived from waste lignocellulosic biomass of Lagenaria vulgaris: kinetics, equilibrium and thermodynamics. International Journal of Environmental Research. 15, 1, 215-230.
OKUMURA, F.; SOARES, M. H. F. B.; CAVALHEIRO, É. T. G. (2002). Identificação de pigmentos naturais de espécies vegetais utilizando-se cromatografia em papel. Química Nova. 25, 4, 680-683.
ONU. (2024). NAÇÕES UNIDAS BRASIL. Disponível em: https://brasil.un.org/pt-br/sdgs Acesso em: 14 Out., 2024.
PALETTA, F. C.; DE AQUINO, A. R.; CAMELLO, T. C. F.; MARTINS, T. P.; DE ALMEIDA, J. R. Sustentabilidade ambiental. 1. ed. Rio de Janeiro: Rede Sirius, OUERJ, 2015. Disponível em: https://osf.io/preprints/osf/wpgzn
PANDEY, P.; KHAN, F. (2021). A mechanistic review of the anticancer potential of hesperidin, a natural flavonoid from citrus fruits. Nutrition Research. 92, 21-31.
PINTOS, J.; FRANCO, E. L.; OLIVEIRA, B. V.; KOWALSKI, L. P.; CURADO, M. P.; DEWAR, R. (1994). Mate, coffee, and tea consumption and risk of cancers of the upper aerodigestive tract in southern Brazil. Epidemiology. 5, 6, 583-590.
PITURA, K.; ARNTFIELD, S. D. (2019). Characteristics of flavonol glycosides in bean (Phaseolus vulgaris L.) seed coats. Food Chemistry. 272, 26-32.
POSADINO, A. M., et al. (2023). An updated overview of cyanidins for chemoprevention and cancer therapy. Biomedicine & Pharmacotherapy. 163, 114783.
RAKHA, A.; UMAR, N.; RABAIL, R.; BUTT, M. S.; KIELISZEK, M.; HASSOUN, A.; AADIL, R. M. (2022). Anti-inflammatory and anti-allergic potential of dietary flavonoids: A review. Biomedicine & Pharmacotherapy. 156, 113945.
RIZK, M. Z.; ABO-EL-MATTY, D. M.; ALY, H. F.; ABD-ALLA, H. I.; SALEH, S. M.; YOUNIS, E. A.; ELNAHRAWY, A. M.; HAROUN, A. A. (2018). Therapeutic activity of sour orange albedo extract and abundant flavanones loaded silica nanoparticles against acrylamide-induced hepatotoxicity. Toxicology Reports.
RODRÍGUEZ-ARCE, E.; SALDÍAS, M. (2021). Antioxidant properties of flavonoid metal complexes and their potential inclusion in the development of novel strategies for the treatment against neurodegenerative diseases. Biomedicine & Pharmacotherapy. 143, 112236.
SAIDELLES, A. P. F.; KIRCHNER, R. M.; SANTOS, N. D.; FLORES, E.; BARTZ, F. R. (2010). Análise de metais em amostras comerciais de erva-mate do sul do Brasil. Alimentos e Nutrição Araraquara. 21, 2, 259-266.
SANDRE, A. A.; PINA, J. M.; MORAES, R. M.; FURLAN, C. M. (2014). Anthocyanins and tannins: is the urban air pollution an elicitor factor? Brazilian Journal of Botany. 37, 1, 9-18.
SANTIN, D.; BENEDETTI, E. L.; DE BARROS, N. F.; FONTES, L. L.; CARVALHO DE ALMEIDA, I.; LIMA NEVES, J. C.; WENDLING, I. (2017). Manejo de colheita e adubação fosfatada na cultura da erva-mate (Ilex paraguariensis) em fase de produção. Ciência Florestal. 27, 3.
SANTOS, E. L.; MAIA, B.; FERRIANI, A. P.; TEIXEIRA, S. D. (2017). Flavonoids: Classification, biosynthesis and chemical ecology. Flavonoids-From Biosynthesis to Human Health. 13, 78-94.
SANTOS, J. S.; DEOLINDO, C. T. P.; HOFFMANN, J. F.; CHAVES, F. C.; DO PRADO-SILVA, L.; SANT'ANA, A. S.; AZEVEDO, L.; DO CARMO, M. A. V.; GRANATO, D. (2018). Optimized Camellia sinensis var. sinensis, Ilex paraguariensis, and Aspalathus linearis blend presents high antioxidant and antiproliferative activities in a beverage model. Food Chemistry. 254, 348-358.
SEKOWSKI, S.; BITIUCKI, M.; IONOV, M.; ZDEB, M.; ABDULLADJANOVA, N.; RAKHIMOV, R.; MAVLYANOV, S.; BRYSZEWSKA, M.; ZAMARAEVA, M. (2018). Influence of valoneoyl groups on the interactions between Euphorbia tannins and human serum albumin. Journal of Luminescence. 194, 170-178.
SILVA, E. F. L. D.; NICOLINI, J. Estudo da presença de antocianinas totais em folhas de erva-mate. Anais X Contextos e Conceitos, Mostra de Produção Científica e Extensão Palmas, Brasil. 2020
SILVA, J. M. D.; MARTINS, R. D. C.; BERNARDI, F.; SANTOS, C. D. M. R. D.; NICOLINI, K. P.; NICOLINI, J. (2020). Extratos de Lilium sp., Agapanthus sp. e Hydrangea sp.: Comportamento como indicadores naturais em diferentes faixas de pH. Química Nova. 43, 2, 231-238.
SILVA, S.; COSTA, E.; CALHAU, C.; MORAIS, R.; PINTADO, M. (2017). Anthocyanin extraction from plant tissues: A review. Critical Reviews in Food Science and Nutrition. 57, 14, 3072-3083.
SIMÕES, C. M. O.; SCHENKEL, E. P.; GOSMANN, G.; DE MELLO, J. C.; MENTZ, L. A.; PETROVICK, P. R. Farmacognosia: da planta ao medicamento 5a ed. UFRGS/UFSC: Porto Alegre/Florianópolis, 2003.
SOUZA, A. H. P.; CORRÊA, R. C. G.; BARROS, L.; CALHELHA, R. C.; SANTOS-BUELGA, C.; PERALTA, R. M.; BRACHT, A.; MATSUSHITA, M.; FERREIRA, I. C. F. R. (2015). Phytochemicals and bioactive properties of Ilex paraguariensis: An in-vitro comparative study between the whole plant, leaves and stems. Food Research International. 78, 286-294.
STAGG, G. V.; MILLIN, D. J. (1975). The nutritional and therapeutic value of tea - A review. Journal of the Science of Food and Agriculture. 26, 10, 1439-1459.
STANKOVIĆ, M. N.; KRSTIĆ, N. S.; MITROVIĆ, J. Z.; NAJDANOVIĆ, S. M.; PETROVIĆ, M. M.; BOJIĆ, D. V.; DIMITRIJEVIĆ, V. D.; BOJIĆ, A. L. (2016). Biosorption of copper(II) ions by methyl-sulfonated Lagenaria vulgaris shell: kinetic, thermodynamic and desorption studies. New Journal of Chemistry. 40, 3, 2126-2134.
TAO, H.; ZHAO, Y.; LI, L.; HE, Y.; ZHANG, X.; ZHU, Y.; HONG, G. (2023). Comparative metabolomics of flavonoids in twenty vegetables reveal their nutritional diversity and potential health benefits. Food Research International. 164, 112384.
TERTULIA. (2024). Modo de preparo do chimarrão. Disponível em: https://tertulia.com.br/modo-de-preparo/ Acesso em 11 jun., 2024.
VEITCH, N. C.; GRAYER, R. J. (2008). Flavonoids and their glycosides, including anthocyanins. Natural Product Reports. 25, 3, 555-611.
WASILEWSKA, A.; KLEKOTKA, U.; ZAMBRZYCKA, M.; ZAMBROWSKI, G.; ŚWIĘCICKA, I.; KALSKA-SZOSTKO, B. (2023). Physico-chemical properties and antimicrobial activity of silver nanoparticles fabricated by green synthesis. Food Chemistry. 400, 133960.
WILLIAMS, C. A.; GRAYER, R. J. (2004). Anthocyanins and other flavonoids. Natural Product Reports. 21, 4, 539-573.
WROLSTAD, R. E. (2004). Anthocyanin pigments - Bioactivity and coloring properties. Journal of Food Science. 69, 5, C419-C425.
WROLSTAD, R. E.; DURST, R. W.; LEE, J. (2005). Tracking color and pigment changes in anthocyanin products. Trends in Food Science & Technology. 16, 9, 423-428.
YANG, Y.; TREVETHAN, M.; WANG, S.; ZHAO, L. (2022). Beneficial effects of citrus flavanones naringin and naringenin and their food sources on lipid metabolism: An update on bioavailability, pharmacokinetics, and mechanisms. The Journal of Nutritional Biochemistry. 104, 108967.
YOSHIDA, K.; MORI, M.; KONDO, T. (2009). Blue flower color development by anthocyanins: from chemical structure to cell physiology. Natural Product Reports. 26, 7, 884-915.